
Острое кровотечение из верхних отделов желудочно–кишечного тракта (ЖКТ), определяемое как кровотечение, источник которого располагается проксимальнее связки Трейтца, является частым и клинически важным состоянием, оказывающим существенное влияние на расходы здравоохранения во всех странах мира. Среди негативных последствий этого явления следует назвать повторное кровотечение и смерть, которая во многих случаях связана с декомпенсацией существующих заболеваний, вызванной острым кровотечением [1]. В настоящем обзоре речь пойдет о лечении пациентов с острым язвенным кровотечением.
Эпидемиология
Ежегодно в Соединенных Штатах Америки происходит 160 госпитализаций в связи с острым желудочно–кишечным кровотечением (ЖКК) на 100 тыс. жителей, что соответствует более чем 400 тыс. госпитализаций в год [2]. Большая часть (80–90%) эпизодов острого кровотечения не связана с варикозным расширением вен пищевода и вызван язвами желудка и двенадцатиперстной кишки [3]. Хотя в нескольких работах было высказано предположение, что число язвенных кровотечений в мире может снижаться [4], недавно были опубликованы данные о том, что частота их встречаемости составляет 60 на 100 тыс. населения [5], при этом все большее число подобных кровотечений связано с приемом ацетилсалициновой кислоты и нестероидных противовоспалительных препаратов (НПВП). Кроме того, в большинстве случаев язвенные кровотечения развиваются у пожилых, так как 68% случаев составляют люди в возрасте старше 60 лет, а 27% – в возрасте старше 80 лет [6]. Смертность от язвенных кровотечений продолжает оставаться высокой, находясь в пределах от 5 до 10% [1,3]. По существующим оценкам, непосредственные расходы на стационарное лечение пациентов с язвенными кровотечениями в Соединенных Штатах Америки превышают 2 млрд долларов в год [7].
Клиническая картина
Первичное ведение пациентов
Рвота с кровью и мелена являются наиболее частыми первыми проявлениями острого язвенного кровотечения. Мелена в некоторых случаях имеет место у пациентов с кровотечениями из нижних отделов ЖКТ (т.е. дистальной тонкой и толстой кишки), а у пациентов с кровотечением из верхних отделов может иметь место примесь крови в кале [8]. Важна оценка состояния гемодинамики, включающая тщательное измерение пульса и артериального давления (АД), в том числе анализ ортостатических изменений для оценки объема внутрисосудистой жидкости и проведения реанимационных мероприятий. У пациентов с острым язвенным кровотечением и значительным снижением объема внутрисосудистой жидкости отмечается тахикардия в покое (пульс более или равен 100 уд./мин), гипотензия (систолическое артериальное давление менее 100 мм рт.ст.) или значительные ортостатические изменения (ускорение пульса на 20 и более уд./мин или снижение АД на 20 и более мм рт.ст. при вставании) [9,10]. Также должны быть оценены состояние слизистых, вен шеи и объем выделяемой мочи, так как они косвенно отражают состояние внутрисосудистого объема жидкости [9].
Первой задачей лечения является восстановление потерь жидкости и гемодинамической стабильности. Необходимо начать введение кристаллоидных растворов с применением крупных венозных катетеров (например, двух периферических катетров 16–18–го размера или центрального катетера при невозможности установки периферических). В целях поддержания адекватной способности крови к транспортировке кислорода, особенно у пожилых людей с сопутствующими сердечно–сосудистыми заболеваниями, следует рассмотреть возможность применения кислорода и переливания плазмы крови и эритроцитов при наличии тахикардии, гипотензии или снижения уровня гемоглобина ниже 10 г/дцл [9,11]. При наличии показаний также следует проводить коррекцию коагулопатии [12].
Введение назогастрального зонда может быть весьма полезным на первичном этапе обследования пациента (особенно для определения тяжести заболевания), хотя мнение о ценности данной процедуры продолжает оставаться противоречивым [10]. Было высказано предположение, что наличие алой крови в аспирате из назогастрального зонда является плохим прогностическим признаком, указывающим на необходимость срочного эндоскопического обследования [10,13]. В то же время отсутствие крови или материла, напоминающего кофейную гущу, не является гарантией отсутствия кровотечения, так как у 15% подобных пациентов при эндоскопическом обследовании были выявлены поражения высокого риска [10]. Применение орогастральных зондов большого диаметра для промывания желудка (водой комнатной температуры) улучшает визуализацию желудочного дна при эндоскопии, но не результаты лечения [14]. Внутривенное введение эритромицина, являющегося агонистом рецепторов мотилина, усиливает перистальтику желудка и значительно улучшает визуализацию его слизистой при первичной эндоскопии. Однако повышение диагностической ценности эндоскопии или улучшение результатов лечения в результате введения эритромицина доказаны не были (табл. 1) [18].
Сортировка пациентов и определение риска
Разработаны критерии, основанные на клинических признаках (т.е. не на данных эндоскопии), которые позволяют ускорить сортировку пациентов с острым ЖКК, выявить нуждающихся в срочном вмешательстве, прогнозировать риск осложнений и определить оптимальный метод лечения [19,20]. Шкала Blatchford, общепризнанный метод классификации степени риска, основанный на клинических и лабораторных данных, используется для прогнозирования необходимости медицинского вмешательства у пациентов с кровотечением из верхних отделов ЖКТ (табл. 2) [16]. Данный показатель может находиться в пределах от 0 до 23, при этом более высокие значения указывают на больший риск. Шкала Rockall является, вероятнее всего, наиболее известной системой определения риска при кровотечениях из верхних отделов ЖКТ, и ее эффективность была доказана в различных условиях (табл. 2) [17]. Клинический показатель Rockall (т.е. рассчитываемый до эндоскопии) получают исключительно на основании клинических данных непосредственно при поступлении. Полный показатель Rockall включает как клинические, так и эндоскопические данные и позволяет прогнозировать риск повторного кровотечения и смерти, он варьирует от 0 до 11 баллов, при этом более высокие значения указывают на более высокий риск. Оба эти показателя (Rockall и Blatchford) полезны в определении прогноза пациентов, поступающих с острым кровотечением из верхних отделов ЖКТ, и имеют общие черты, включая данные о гемодинамическом состоянии и сопутствующих заболеваниях; применение этих шкал позволяет снизить число экстренных эндоскопических вмешательств среди пациентов, имеющих низкий риск [21]. Предложены и другие методы определения риска [20]. В настоящее время рекомендуется применение подобных шкал в качестве дополнения к клинической оценке состояния больных.
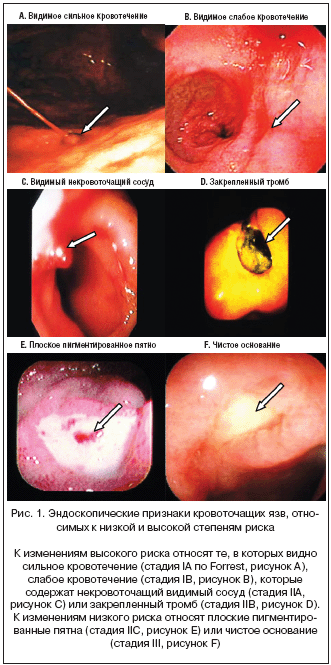
Эндоскопическая картина кровоточащей язвы может быть использована для прогнозирования повторного кровотечения на основании классификации Forrest, в которой выделяют категории от IA до III. К числу изменений высокого риска относят язвы с видимым сильным (категория IA) или слабым кровотечением (категория IB), видимым сосудом, описываемым как пигментированный выступ, без кровотечения (категория IIA) и закрепленным тромбом (определяемым как красное или черное образование аморфной консистенции, которое невозможно сместить путем отсасывания или полива водой под давлением) (категория IIB) (рис. 1A–1D).
Поражения низкого риска включают плоские, пигментированные пятна (категория IIC) и язвы с чистым дном (категория III) (рис. 1E и 1F) [8,22–24]. Зависимость правильности определения категории язвы от квалификации специалиста, выполняющего исследование, низка [25].
При первичном эндоскопическом исследовании изменения высокого риска выявляются примерно в диапазоне от одной трети до половины случаев [3], при этом частота повторных кровотечений из этих язв составляет от 22 до 55%, если их не пытались лечить эндоскопически [8,22,24]. Для подтверждения самостоятельной диагностической ценности эндоскопического доплеровского ультразвукового исследования области кровотечения до и после воздействия на нее с целью остановки кровотечения в отношении определения риска необходимы дополнительные исследования [26].
Подходы к лечению
Рекомендуется совместное лечение различными специалистами со своевременным привлечением специально подготовленного эндоскописта [9,19,27]. Подобная тактика требует круглосуточной доступности подобных специалистов в связи с тем, что ранняя эндоскопия (выполненная в течение 24 ч после обращения пациента) является краеугольным камнем лечения пациентов с острым кровотечением из верхних отделов ЖКТ и может улучшать отдельные результаты лечения (количество перелитой крови и длительность госпитализации) в случае пациентов, отнесенных к группе высокого риска. Ранняя эндоскопия также позволяет определить показания к безопасной выписке пациентов, отнесенных к группе низкого риска, таким образом снижая расходы на их лечение [19,28]. Целями ранней эндоскопии являются определение источника кровотечения, прогноза и проведение эндоскопического лечения при наличии показаний. Рекомендации по лечению касаются прежде всего первых 72 ч после поступления и эндоскопического обследования и лечения, так как риск повторного кровотечения наиболее высок именно в этот период (табл. 1) [24,29].
Пациенты из группы высокого риска
Пациенты с высоким риском должны быть госпитализированы, им следует провести эндоскопическое исследование и назначить лечение. Необходимо определить нуждаются ли они в помещении в отделение интенсивной терапии или достаточно усиленного наблюдения в течение первых 24 ч, при этом общая длительность госпитализации составляет как правило около 72 ч.
Пациентам с кровоточащими язвами, отнесенными к группе высокого риска при эндоскопии (активное кровотечение или видимый кровеносный сосуд), должен быть выполнен эндоскопический гемостаз, который снижает риск повторного кровотечения, экстренного оперативного вмешательства и смерти [19,27,30]. К числу современных методов эндоскопического вмешательства относят инъекции (например, физиологического раствора, вазоконстрикторов, склерозирующих веществ, препаратов, склеивающих ткани, или их комбинаций), термальные воздействия (контактные, такие как многополярная электрокоагуляция, и бесконтактные, такие как коагуляция с применением аргоновой плазмы) или механические воздействия (прежде всего эндоскопическое клипирование).
Все методы эндоскопических вмешательств доказанно превосходят отсутствие какого–либо вмешательства [19,27]. В то же время добавление второго метода гемостаза (инъекции, термального воздействия) к введению адреналина (в физиологическом растворе в разведении 1 к 10 000) в еще большей степени снижает вероятность повторного кровотечения, оперативных вмешательств и смерти [31] по сравнению с только введением адреналина, которого следует избегать [27,32]. Хотя эффективность введения только склерозирующего вещества считается сомнительной, оно редко приводит к повреждению тканей [33].
Существующие рекомендации считают более предпочтительным комбинированное лечение (введение адреналина с целью достижения местной вазоконстрикции и облегчения визуализации кровоточащего сосуда с последующим термальным воздействием) [19], однако преимущества комбинированного лечения перед только термальным воздействием доказаны не окончательно [32]. Возможность эндоскопического лечения среди пациентов с высоким риском, имеющих закрепленный тромб, остается дискуссионным вопросом (табл. 1) [15,19,34–36].
Применение методов механического воздействия, прежде всего эндоскопической установки клипс, считается весьма перспективным [19]. Точная роль этого метода окончательно не определена, существующие данные указывают на эффективность, аналогичную только термальному воздействию, комбинации инъекции и контактного термального воздействия, а также установке клипс в сочетании с инъекцией [32,37]. Этот вопрос требует дальнейшего изучения. Возможно, в будущем оптимальный метод лечения будет зависеть от расположения и внешнего вида язвы. В настоящее время эндоскопистам следует применять те методы гемостаза, которые они лучше знают, так как все эти методы достаточно эффективны. Однако применение только инъекции эпинефрина является неоправданным. Точная роль новых методов эндоскопического гемостаза, таких как криотерапия, ушивание и применение металлических клипс, должна быть установлена в будущих исследованиях.
Различные клинические и эндоскопические факторы были предложены для прогнозирования эффективности эндоскопического лечения у пациентов с язвенным кровотечением. Они включают наличие язвенной болезни в анамнезе, наличие язвенных кровотечений в анамнезе, поступление в состоянии шока, активное кровотечение во время эндоскопического исследования, большой размер язвы (более 2 см в диаметре), большой размер сосуда, из которого происходит кровотечение ( ?2 мм в диаметре), а также расположение язвы на малой кривизне желудка, или на задней стенке, или в верхней части луковицы двенадцатиперстной кишки [38,39].
Обязательное выполнение повторной эндоскопии в течение первых 24 ч после первого исследования не рекомендуется [19,27]: хотя эффективность подобной процедуры была подтверждена в двух мета–анализах [40,41], снижение частоты рецидивов кровотечения является небольшим. Кроме того, данное вмешательство может оказаться неэффективным с финансовой точки зрения при применении медикаментозной терапии, нацеленной на подавление выделения кислоты [42]. В некоторых случаях можно рассмотреть вопрос о выполнении повторной эндоскопии в индивидуальном порядке при наличии клинических признаков повторного кровотечения или неуверенности в эффективности первого вмешательства.
Пациенты из группы низкого риска
Значительная часть пациентов, госпитализированных с острым кровотечением из верхних отделов ЖКТ, не связанным с варикозным расширением вен пищевода, имеют низкий риск повторного кровотечения и смерти [43–45]. Результаты рандомизированных и ретроспективных исследований показали, что после эндоскопии пациенты с низким риском могут быть выписаны домой, в зависимости от того, когда было выполнено эндоскопическое исследование [46–50]. Основные критерии для выбора метода ведения пациентов из группы низкого риска представлены в таблице 3 [43,44,47–51]. Пациенты с низким риском, не соответствующие этим критериям, должны быть госпитализированы для дальнейшего наблюдения.
Медикаментозное лечение
В течение последних 10 лет основной целью медикаментозного лечения пациентов с кровотечением из верхних отделов ЖКТ, не связанным с варикозным расширением вен пищевода, являлось подавление выработки кислоты с применением ингибиторов протонного насоса. Экспериментальные данные показали, что соляная кислота желудка препятствует формированию тромбов, способствует разделению тромбоцитов и фибринолизу [52]. В этой связи угнетение выработки кислоты и повышение уровня внутрижелудочного рН до 6 и выше с поддержанием этого уровня способствует стабильности тромбов, таким образом снижая вероятность повторного кровотечения. Стоит, впрочем, отметить, что ориентир внутрижелудочной кислотности 6 является чисто теоретическим и его клиническое значение в лечении язвенных кровотечений не доказано. Более того, хотя данные клинических исследований подтверждают эффективность болюсного введения с последующей поддерживающей инфузией ингибиторов протонного насоса, последние исследования из Северной Америки показывают, что даже введение этих препаратов в высоких дозах может не позволить поддерживать внутрисосудистый рН на уровне 6 и выше [53]. Применение антагонистов гистаминовых Н2–рецепторов (Н2–блокаторов) у пациентов с язвенными кровотечениями не приводит к достоверному улучшению результатов лечения [54], вероятнее всего вследствие развития фармакологической толерантности к их действию.
Мощные ингибиторы протонного насоса не вызывают развития тахифилаксии и высокоэффективны клинически [55]. Проведенный недавно мета–анализ показал, что применение ингибиторов протонного насоса достоверно снижает риск повторных язвенных кровотечений (отношение шансов 0,40; 95%–ный доверительный интервал (ДИ) от 2,24 до 0,67), необходимость в проведении экстренных оперативных вмешательств (отношение шансов 0,50; 95%–ный ДИ от 0,33 до 0,76) и риск смерти (отношение шансов 0.53; 95%–ный ДИ от 0,31 до 0,91) (рис. 2А и 2В) [56,57]. Эти данные также подтверждаются клинической практикой [3]. Однако снижение риска прежде всего имеет место в группе пациентов с высоким риском, которым сначала было проведено эндоскопическое лечение, это свидетельство, что медикаментозное лечение является дополнением, но не заменой эндоскопических вмешательств [34,57].
В настоящее время существует лишь ограниченное число данных об эффективности внутривенного введения ингибиторов протонного насоса у пациентов с острым язвенным кровотечением, полученных в рандомизированных клинических исследованиях в Соединенных Штатах Америки. Недавнее исследование, в котором сравнивали применение высоких доз ингибиторов протонного насоса с Н2–блокаторами, было остановлено в связи с медленным набором пациентов, и хотя была отмечена тенденция к более высокой эффективности ингибиторов протонной помпы, исследование было недостаточно крупным для того, чтобы это различие достигло степени статистической достоверности [58]. Кроме того, важным является дозирование ингибиторов протонного насоса. Обобщенный анализ 16 рандомизированных исследований, включавший более 3800 пациентов, показал, что введение внутривенного болюса с последующей поддерживающей инфузией более эффективно, чем только болюс, в отношении снижения вероятности повторного кровотечения и оперативного лечения [59]. В этой связи в настоящее время рекомендуется введение внутривенного болюса ингибитора протонного насоса с последующей поддерживающей инфузией в течение 72 ч после эндоскопического вмешательства, хотя оптимальная доза продолжает оставаться спорной (табл. 1). Также было подтверждено, что применение высоких доз внутривенных ингибиторов протонного насоса является более эффективным и менее дорогостоящим в различных клинических условиях [60,61].
Введение высоких доз внутривенных ингибиторов протонного насоса до эндоскопического вмешательства не влияет на результаты лечения, хотя может привести к отнесению самой язвы к менее опасной форме. Иными словами, пациенты, получившие такое лечение, имеют меньшую вероятность быть отнесенными к группе высокого риска по сравнению с получавшими плацебо (отношение шансов 0,67; 95%–ный ДИ от 0,54 до 0,84) [62]. Таким образом, эти пациенты реже нуждаются в выполнении эндоскопических манипуляций с целью гемостаза (19,1 и 28,4%, р=0,007) [63]. Экономическая эффективность подобного применения ингибиторов протонного насоса продолжает оставаться спорной [64,65].
Применение больших доз пероральных ингибиторов протонного насоса при язвенных кровотечениях оказалось эффективным в исследованиях, проведенных в Азии, приводя к снижению риска повторных кровотечений (отношение шансов 0,24; 95%–ный ДИ от 0,16 до 0,36), оперативных вмешательств (отношение шансов 0,29; 95%–ный ДИ от 0,16 до 0,53) и смерти (отношение шансов 0,35; 95%–ный ДИ от 0,16 до 0,74) [66]. Впрочем, эти результаты могут быть неприменимы для жителей Северной Америки и Европы в связи с имеющимися различиями в физиологии, фармакологических особенностях (метаболизме ингибиторов протонного насоса цитохромами Р–450 2С19, зависящем от генетического полиморфизма), а также частотой встречаемости Helicobacter pylori, которые могут повышать эффективность указанных препаратов именно среди азиатских пациентов [66]. Необходимы дополнительные данные о сравнительной эффективности внутривенных и пероральных ингибиторов протонного насоса, полученные в рандомизированных клинических исследованиях в западных странах, так как применение пероральных препаратов может позволить достичь существенной экономии при лечении [61].
Соматостатин и его аналог октреотид угнетают секрецию как кислоты, так и пепсина, а кроме этого снижают интенсивность кровотока в стенках желудка и двенадцатиперстной кишки. Тем не менее эти препараты не считают стандартным методом лечения пациентов с язвенным кровотечением в связи с тем, что проведенные рандомизированные исследования не выявили существенного эффекта от их применения как в форме монотерапии, так и в сочетании с Н2–блокаторами [67]. Более того, нет также подтверждений целесообразности применения этих препаратов в качестве дополнения к эндоскопическим вмешательствам.
Хирургическое лечение и интервенционная радиология
Мета–анализы показывают снижение числа оперативных вмешательств до 6,5–7,5% [31], что подтверждается данными национальными статистическими данными [3], однако эпидемиологические исследования показывают увеличение числа экстренных хирургических операций с 5,2 до 7,0 на 100 тыс. жителей в год в период с 1987 по 1999 г. [68]. В связи с лучшим пониманием природы язвенной болезни значение хирургических вмешательств в ее лечении в последние два десятилетия значительно снизилось, в частности на сегодняшний день консультация хирурга не считается обязательным компонентом обследования пациентов с острым кровотечением из верхних отделов ЖКТ. Целью экстренных оперативных вмешательств является не излечение болезни, а остановка кровотечения в тех случаях, когда эндоскопического вмешательства недостаточно или оно недоступно. Роль раннего планового оперативного вмешательства все еще окончательно не определена, так же как и оптимальная хирургическая методика у пациентов с острым процессом [69,70]. Недавно проведенный анализ, в котором сравнивали ваготомию с дренированием и ваготомию с резекцией желудка, не выявил достоверных различий [71]. Хирургическое вмешательство продолжает оставаться безопасным и эффективным методом лечения для отдельных групп пациентов с неконтролируемым кровотечением (т.е. тех, у кого не получается добиться стабилизации гемодинамики путем переливания кристаллоидов и продуктов крови), а также больных, которые могут не перенести рецидив или усиление кровотечения [72]. У большинства пациентов с признаками продолжающегося или повторного кровотечения вторая попытка эндоскопического вмешательства с целью достижения гемостаза в большинстве случаев оказывается эффективной, может реже сопровождаться осложнениями по сравнению с хирургическим вмешательством и является рекомендуемым методом лечения [3,73]. Исключениями могут быть пациенты с язвами более 2 см в диаметре, а также те, у кого развивается гипотензия на фоне повторного кровотечения: у них повышен риск неэффективности второго эндоскопического вмешательства [27,73].
Ангиография с чрезкатетерной эмболизацией является еще одним методом неоперативного лечения пациентов, у которых кровотечение не было остановлено или его очаг не был выявлен при эндоскопии. Для эмболизации кровоточащих сосудов применяют такие вещества, как Gelfoam, поливинил этанол, цианакриловые клеи и кольца [74]. Эффективность подобных вмешательств варьирует в пределах от 52 до 94%, а частота повторных кровотечений, требующих эмболизации, составляет около 10% [75]. В исследованиях без контрольной группы было показано, что эмболизация значительно снижает смертность пациентов с кровотечениями из верхних отделов ЖКТ [74], хотя в некоторых случаях и сопровождается такими осложнениями, как кишечная ишемия, вторичный дуоденальный стеноз, а также инфаркты желудка, печени и селезенки [75]. В большинстве клиник радиологические вмешательства выполняют у пациентов, которым не помогли эндоскопические вмешательства, особенно тех из них, кто имеет высокий риск развития осложнений в результате оперативного вмешательства. Ретроспективный анализ не выявил существенных различий между эмболизацией и хирургическими вмешательствами в отношении частоты повторных кровотечений (29,0 и 23,1% соответственно), необходимости выполнения дополнительных оперативных вмешательств (16,1 и 30,8%) и смертности (25,8 и 20,5%), несмотря на старший возраст и более высокую частоту сердечно–сосудистых заболеваний в группе пациентов, которым выполняли эмболию [76]. Хотя радиологическое вмешательство может в ряде случаев не быть окончательно излечивающим, оно позволяет стабилизировать состояние пациента до того момента, когда можно будет провести другое лечение [74].
Хотя обсуждение долгосрочного лечения пациентов с острым язвенным кровотечением выходит за рамки настоящей статьи, мы считаем необходимым упомянуть о крайней важности выявления и лечения H. pylori [77]. Кроме того, у отдельных пациентов важным является установление необходимости приема НПВП, а также дезагрегантов, и если подобное лечение требуется, следует также назначать им гастропротективные препараты [78].
Реферат подготовлен к.м.н. В.В. Иремашвили по материалам статьи I.M. Gralnek , A.N. Barkun,
M. Bardou. «Management of acute bleeding from
a peptic ulcer», New England Journal of Medicine 2008; 359: 928–937




Литература
1. Lim CH, Vani D, Shah SG, Everett SM, Rembacken BJ. The outcome of suspected upper gastrointestinal bleeding with 24–hour access to upper gastrointestinal endoscopy: a prospective cohort study. Endoscopy 2006;38:581–5.
2. Lewis JD, Bilker WB, Brensinger C, Farrar JT, Strom BL. Hospitalization and mortality rates from peptic ulcer disease and GI bleeding in the 1990s: relationship to sales of nonsteroidal anti–inflammatory drugs and acid suppression medications. Am J Gastroenterol 2002;97:2540–9.
3. Barkun A, Sabbah S, Enns R, et al. The Canadian Registry on Nonvariceal Upper Gastrointestinal Bleeding and Endoscopy (RUGBE): endoscopic hemostasis and proton pump inhibition are associated with improved outcomes in a real–life setting. Am J Gastroenterol 2004;99:1238–46.
4. Targownik LE, Nabalamba A. Trends in management and outcomes of acute nonvariceal upper gastrointestinal bleeding: 1993–2003. Clin Gastroenterol Hepatol 2006;4:1459–66. [Erratum, Clin Gastroenterol Hepatol 2007;5:403.]
5. Lassen A, Hallas J, Schaffalitzky de Muckadell OB. Complicated and uncomplicated peptic ulcers in a Danish county 1993–2002: a population–based cohort study. Am J Gastroenterol 2006;101:945–53.
6. Ohmann C, Imhof M, Ruppert C, et al. Time–trends in the epidemiology of peptic ulcer bleeding. Scand J Gastroenterol 2005;40:914–20.
7. Viviane A, Alan BN. Estimates of costs of hospital stay for variceal and nonvariceal upper gastrointestinal bleeding in the United States. Value Health 2008;11:1–3.
8. Laine L, Peterson WL. Bleeding peptic ulcer. N Engl J Med 1994;331:717–27.
9. British Society of Gastroenterology Endoscopy Committee. Non–variceal upper gastrointestinal haemorrhage: guidelines. Gut 2002;51:Suppl 4:iv1–iv6.
10. Aljebreen AM, Fallone CA, Barkun AN. Nasogastric aspirate predicts high–risk endoscopic lesions in patients with acute upper–GI bleeding. Gastrointest Endosc 2004;59:172–8.
11. Hebert PC, Wells G, Blajchman MA, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. N Engl J Med 1999;340:409–17. [Erratum, N Engl J Med 1999;340:1056.]
12. Baradarian R, Ramdhaney S, Chapalamadugu R, et al. Early intensive resuscitation of patients with upper gastrointestinal bleeding decreases mortality. Am J Gastroenterol 2004;99:619–22.
13. Corley DA, Stefan AM, Wolf M, Cook EF, Lee TH. Early indicators of prognosis in upper gastrointestinal hemorrhage. Am J Gastroenterol 1998;93:336–40.
14. Lee SD, Kearney DJ. A randomized controlled trial of gastric lavage prior to endoscopy for acute upper gastrointestinal bleeding. J Clin Gastroenterol 2004; 38:861–5.
15. Jensen DM, Kovacs TO, Jutabha R, et al. Randomized trial of medical or endoscopic therapy to prevent recurrent ulcer hemorrhage in patients with adherent clots. Gastroenterology 2002;123:407–13.
16. Blatchford O, Murray WR, Blatchford M. A risk score to predict need for treatment for upper–gastrointestinal haemorrhage. Lancet 2000;356:1318–21.
17. Rockall TA, Logan RF, Devlin HB, Northfield TC. Risk assessment after acute upper gastrointestinal haemorrhage. Gut 1996;38:316–21.
18. Carbonell N, Pauwels A, Serfaty L, Boelle PY, Becquemont L, Poupon R. Erythromycin infusion prior to endoscopy for acute upper gastrointestinal bleeding: a randomized, controlled, double–blind trial. Am J Gastroenterol 2006;101:1211–5.
19. Barkun A, Bardou M, Marshall JK. Consensus recommendations for managing patients with nonvariceal upper gastrointestinal bleeding. Ann Intern Med 2003;139:843–57.
20. Das A, Wong RC. Prediction of outcome of acute GI hemorrhage: a review of risk scores and predictive models. Gastrointest Endosc 2004;60:85–93.
21. Romagnuolo J, Barkun AN, Enns R, Armstrong D, Gregor J. Simple clinical predictors may obviate urgent endoscopy in selected patients with nonvariceal upper gastrointestinal tract bleeding. Arch Intern Med 2007;167:265–70.
22. Forrest JA, Finlayson ND, Shearman DJ. Endoscopy in gastrointestinal bleeding. Lancet 1974;2:394–7.
23. Consensus conference: therapeutic endoscopy and bleeding ulcers. JAMA 1989; 262:1369–72.
24. Freeman ML, Cass OW, Peine CJ, Onstad GR. The non–bleeding visible vessel versus the sentinel clot: natural history and risk of rebleeding. Gastrointest Endosc 1993;39:359–66.
25. Lau JY, Sung JJ, Chan AC, et al. Stigmata of hemorrhage in bleeding peptic ulcers: an interobserver agreement study among international experts. Gastrointest Endosc 1997;46:33–6.
26. Wong RC. Endoscopic Doppler US probe for acute peptic ulcer hemorrhage. Gastrointest Endosc 2004;60:804–12.
27. Adler DG, Leighton JA, Davila RE, et al. ASGE guideline: the role of endoscopy in acute non–variceal upper–GI hemorrhage. Gastrointest Endosc 2004;60:497–504. [Erratum, Gastrointest Endosc 2005; 61:356.]
28. Spiegel BM, Vakil NB, Ofman JJ. Endoscopy for acute nonvariceal upper gastrointestinal tract hemorrhage: is sooner better? A systematic review. Arch Intern Med 2001;161:1393–404.
29. Lau JY, Chung SC, Leung JW, Lo KK, Yung MY, Li AK. The evolution of stigmata of hemorrhage in bleeding peptic ulcers: a sequential endoscopic study. Endoscopy 1998;30:513–8.
30. Cook DJ, Guyatt GH, Salena BJ, Laine LA. Endoscopic therapy for acute nonvariceal upper gastrointestinal hemorrhage: a meta–analysis. Gastroenterology 1992; 102:139–48.
31. Calvet X, Vergara M, Brullet E, Gisbert JP, Campo R. Addition of a second endoscopic treatment following epinephrine injection improves outcome in high–risk bleeding ulcers. Gastroenterology 2004; 126:441–50.
32. Marmo R, Rotondano G, Piscopo R, Bianco MA, D’Angella R, Cipolletta L. Dual therapy versus monotherapy in the endoscopic treatment of high–risk bleeding ulcers: a meta–analysis of controlled trials. Am J Gastroenterol 2007;102:279–89, 469.
33. Park WG, Yeh RW, Triadafilopoulos G. Injection therapies for nonvariceal bleeding disorders of the GI tract. Gastrointest Endosc 2007;66:343–54.
34. Sung JJ, Chan FK, Lau JY, et al. The effect of endoscopic therapy in patients receiving omeprazole for bleeding ulcers with nonbleeding visible vessels or adherent clots: a randomized comparison. Ann Intern Med 2003;139:237–43.
35. Kahi CJ, Jensen DM, Sung JJ, et al. Endoscopic therapy versus medical therapy for bleeding peptic ulcer with adherent clot: a meta–analysis. Gastroenterology 2005;129:855–62. [Erratum, Gastroenterology 2006;131:980–1.]
36. Laine L. Systematic review of endoscopic therapy for ulcers with clots: can a meta–analysis be misleading? Gastroenterology 2005;129:2127–8.
37. Sung JJ, Tsoi KK, Lai LH, Wu JC, Lau JY. Endoscopic clipping versus injection and thermo–coagulation in the treatment of non–variceal upper gastrointestinal bleeding: a meta–analysis. Gut 2007;56:364–73.
38. Chung IK, Kim EJ, Lee MS, et al. Endoscopic factors predisposing to rebleeding following endoscopic hemostasis in bleeding peptic ulcers. Endoscopy 2001;33:969–75.
39. Thomopoulos KC, Theocharis GJ, Vagenas KA, Danikas DD, Vagianos CE, Nikolopoulou VN. Predictors of hemostatic failure after adrenaline injection in patients with peptic ulcers with nonbleeding visible vessel. Scand J Gastroenterol 2004;39:600–4.
40. Marmo R, Rotondano G, Bianco MA, Piscopo R, Prisco A, Cipolletta L. Outcome of endoscopic treatment for peptic ulcer bleeding: is a second look necessary? A meta–analysis. Gastrointest Endosc 2003;57:62–7.
41. Chiu PW–Y, Lau T–S, Kwong K–H, Suen DT–K, Kwok SP–Y. Impact of programmed second endoscopy with appropriate retreatment on peptic ulcer re–bleeding: a systematic review. Ann Coll Surg Hong Kong 2003;7:106–15. Spiegel BM, Ofman 42. JJ, Woods K, Vakil NB. Minimizing recurrent peptic ulcer hemorrhage after endoscopic hemostasis: the cost–effectiveness of competing strategies. Am J Gastroenterol 2003;98:86–97.
43. Rockall TA, Logan RF, Devlin HB, Northfield TC. Selection of patients for early discharge or outpatient care after acute upper gastrointestinal haemorrhage: National Audit of Acute Upper Gastrointestinal Haemorrhage. Lancet 1996;347:1138–40.
44. Longstreth GF, Feitelberg SP. Successful outpatient management of acute upper gastrointestinal hemorrhage: use of practice guidelines in a large patient series. Gastrointest Endosc 1998;47:219–22.
45. Dulai GS, Gralnek IM, Oei TT, et al. Utilization of health care resources for low–risk patients with acute, nonvariceal upper GI hemorrhage: an historical cohort study. Gastrointest Endosc 2002;55: 321–7.
46. Hay JA, Maldonado L, Weingarten SR, Ellrodt AG. Prospective evaluation of a clinical guideline recommending hospital length of stay in upper gastrointestinal tract hemorrhage. JAMA 1997;278:2151–6.
47. Lai KC, Hui WM, Wong BC, Ching CK, Lam SK. A retrospective and prospective study on the safety of discharging selected patients with duodenal ulcer bleeding on the same day as endoscopy. Gastrointest Endosc 1997;45:26–30.
48. Moreno P, Jaurrieta E, Aranda H, et al. Efficacy and safety of an early discharge protocol in low–risk patients with upper gastrointestinal bleeding. Am J Med 1998;105:176–81.
49. Lee JG, Turnipseed S, Romano PS, et al. Endoscopy–based triage significantly reduces hospitalization rates and costs of treating upper GI bleeding: a randomized controlled trial. Gastrointest Endosc 1999; 50:755–61.
50. Cipolletta L, Bianco MA, Rotondano G, Marmo R, Piscopo R. Outpatient management for low–risk nonvariceal upper GI bleeding: a randomized controlled trial. Gastrointest Endosc 2002;55:1–5.
51. Bjorkman DJ, Zaman A, Fennerty MB, Lieberman D, Disario JA, Guest–Warnick G. Urgent vs. elective endoscopy for acute non–variceal upper–GI bleeding: an effectiveness study. Gastrointest Endosc 2004; 60:1–8.
52. Barkun AN, Cockeram AW, Plourde V, Fedorak RN. Review article: acid suppression in non–variceal acute upper gastrointestinal bleeding. Aliment Pharmacol Ther 1999;13:1565–84.
53. Metz DC, Am F, Hunt B, Vakily M, Kukulka MJ, Samra N. Lansoprazole regimens that sustain intragastric pH >6.0: an evaluation of intermittent oral and continuous intravenous infusion dosages. Aliment Pharmacol Ther 2006;23:985–95.
54. Levine JE, Leontiadis GI, Sharma VK, Howden CW. Meta–analysis: the efficacy of intravenous H2–receptor antagonists in bleeding peptic ulcer. Aliment Pharmacol Ther 2002;16:1137–42.
55. Lau JYW, Sung JJY, Lee KKC, et al. Effect of intravenous omeprazole on recurrent bleeding after endoscopic treatment of bleeding peptic ulcers. N Engl J Med 2000;343:310–6.
56. Bardou M, Toubouti Y, Benhaberou–Brun D, Rahme E, Barkun AN. Meta–analysis: proton–pump inhibition in high–risk patients with acute peptic ulcer bleeding. Aliment Pharmacol Ther 2005;21:677–86.
57. Leontiadis GI, Sharma VK, Howden CW. Proton pump inhibitor treatment for acute peptic ulcer bleeding. Cochrane Database Syst Rev 2006;1:CD002094.
58. Jensen DM, Pace SC, Soffer E, Comer GM. Continuous infusion of pantoprazole versus ranitidine for prevention of ulcer rebleeding: a U.S. multicenter randomized, double–blind study. Am J Gastroenterol 2006;101:1991–9, 2170.
59. Morgan D. Intravenous proton pump inhibitors in the critical care setting. Crit Care Med 2002;30:Suppl:S369–S372.
60. Barkun AN, Herba K, Adam V, Kennedy W, Fallone CA, Bardou M. High–dose intravenous proton pump inhibition following endoscopic therapy in the acute management of patients with bleeding peptic ulcers in the U S A and Canada: a cost–effectiveness analysis. Aliment Pharmacol Ther 2004;19:591–600.
61. Spiegel BM, Dulai GS, Lim BS, Mann N, Kanwal F, Gralnek IM. The cost–effectiveness and budget impact of intravenous versus oral proton pump inhibitors in peptic ulcer hemorrhage. Clin Gastroenterol Hepatol 2006;4:988–97.
62. Dorward S, Sreedharan A, Leontiadis G, Howden C, Moayyedi P, Forman D. Proton pump inhibitor treatment initiated prior to endoscopic diagnosis in upper gastrointestinal bleeding. Cochrane Database Syst Rev 2006;4:CD005415.
63. Lau JY, Leung WK, Wu JCY, et al. Omeprazole before endoscopy in patients with gastrointestinal bleeding. N Engl J Med 2007;356:1631–40.
64. Al–Sabah S, Barkun AN, Herba K, et al. Cost–effectiveness of proton–pump inhibition before endoscopy in upper gastrointestinal bleeding. Clin Gastroenterol Hepatol 2008;6:418–25.
65. Tsoi KK, Lau JY, Sung JJ. Cost–effectiveness analysis of high–dose omeprazole infusion prior to endoscopy for patients presenting with upper–GI bleeding. Gastrointest Endosc 2008;67:1056–63.
66. Leontiadis GI, Sharma VK, Howden CW. Systematic review and meta–analysis: enhanced efficacy of proton–pump inhibitor therapy for peptic ulcer bleeding in Asia — a post hoc analysis from the Cochrane Collaboration. Aliment Pharmacol Ther 2005;21:1055–61.
67. Arabi Y, Al Knawy B, Barkun AN, Bardou M. Pro/con debate: octreotide has an important role in the treatment of gastrointestinal bleeding of unknown origin? Crit Care 2006;10:218.
68. Paimela H, Oksala NK, Kivilaakso E. Surgery for peptic ulcer today: a study on the incidence, methods and mortality in surgery for peptic ulcer in Finland between 1987 and 1999. Dig Surg 2004;21:185–91.
69. Poxon VA, Keighley MR, Dykes PW, Heppinstall K, Jaderberg M. Comparison of minimal and conventional surgery in patients with bleeding peptic ulcer: a multicentre trial. Br J Surg 1991;78:1344–5.
70. Millat B, Hay JM, Valleur P, Fingerhut A, Fagniez PL. Emergency surgical treatment for bleeding duodenal ulcer: oversewing plus vagotomy versus gastric resection, a controlled randomized trial. World J Surg 1993;17:568–73.
71. de la Fuente SG, Khuri SF, Schifftner T, Henderson WG, Mantyh CR, Pappas TN. Comparative analysis of vagotomy and drainage versus vagotomy and resection procedures for bleeding peptic ulcer disease: results of 907 patients from the Department of Veterans Affairs National Surgical Quality Improvement Program database. J Am Coll Surg 2006;202:78–86.
72. Imhof M, Ohmann C, Roher HD, Glutig H. Endoscopic versus operative treatment in high–risk ulcer bleeding patients — results of a randomised study. Langenbecks Arch Surg 2003;387:327–36.
73. Lau JYW, Sung JJY, Lam Y, et al. Endoscopic retreatment compared with surgery in patients with recurrent bleeding after initial endoscopic control of bleeding ulcers. N Engl J Med 1999;340:751–6.
74. Kim SK, Duddalwar V. Failed endoscopic therapy and the interventional radiologist: non–variceal upper gastrointestinal bleeding. Tech Gastrointest Endosc 2005;7:148–55.
75. Ljungdahl M, Eriksson LG, Nyman R, Gustavsson S. Arterial embolisation in management of massive bleeding from gastric and duodenal ulcers. Eur J Surg 2002;168:384–90.
76. Ripoll C, Banares R, Beceiro I, et al. Comparison of transcatheter arterial embolization and surgery for treatment of bleeding peptic ulcer after endoscopic treatment failure. J Vasc Interv Radiol 2004;15:447–50.
77. Suerbaum S, Michetti P. Helicobacter pylori infection. N Engl J Med 2002;347:1175–86.
78. Lanas A, Hunt R. Prevention of antiinflammatory drug–induced gastrointestinal damage: benefits and risks of therapeutic strategies. Ann Med 2006;38:415–28.
Gralnek I.M., Barkun A.N., Bardou M.
источник РМЖ

 Опубликовано в категории:
Опубликовано в категории:  Метки:
Метки: